Prof. Dr. Serena DeBeer - Anorganische Spektroskopie
- Prof. Dr. Serena DeBeer
- Direktorin
- Anorganische Spektroskopie
- +49 (0)208 306 - 3656
- serena.debeer(at)cec.mpg.de
- Raum: 608
Vita
| B.S. (Chemie) | Southwestern University, TX, USA (1995) |
| Ph.D. (Chemie) | Stanford University (2002) |
| Beam Line Scientist | SSRL, SLAC, Stanford, University (2001-2003) |
| Staff Scientist | SSRL, SLAC, Stanford, University (2003-2009) |
| Assistenz-Professor | Cornell University, NY, USA (2009-2012) |
| Forschungsgruppenleiterin | MPI für Bioanorganische Chemie; heute: MPI CEC (2011-2017) |
| Gruppenleiterin | PINK Beamline, Energy Materials In-Situ Laboratory, Helmholtz Zentrum, Berlin (seit 2012) |
| Adjunct Professor | Department of Chemistry and Chemical Biology, Cornell University, NY, USA (seit 2012) |
| Honorarprofessur | Ruhr Universität Bochum (seit 2014) |
| Direktorin | Anorganische Spektroskopie, MPI CEC (seit 2017) |
| Honorarprofessur | Universität Duisburg-Essen (seit 2024) |
Publications
Full publications list | ORCID | ResearcherID | Google Scholar Profile
Newest publications
2025
Fang, W., Zhang, Y., Kang, L., DeBeer, S., Leitner, W., Bordet, A., Risager, A. (2025). Molecularly modified aluminum phosphates as support materials for Ru nanoparticles in selective hydrogenation. Journal of Catalysis, 442, 115911. doi:10.1016/j.jcat.2024.115911.
Sengupta, K., Joyce, J. P., Decamps, L., Kang, L. Q., Björnsson, R., Rüdiger, O., DeBeer, S. (2025). Investigating the Molybdenum Nitrogenase Mechanistic Cycle Using Spectroelectrochemistry. Journal of the American Chemical Society. doi:10.1021/jacs.4c16047.
McCubbin Stephanic, O., Pollock, C. J., Zielinski, K. A., Foschi, W., Rice, D. B., Lois, P., DeBeer, S. (2025). Implementation of simultaneous ultraviolet/visible and x-ray absorption spectroscopy with microfluidics. Review of Scientific Instruments, 96 (1) 015107. doi:10.1063/5.0218572.
2024
Zhang, Y. Y., Levin, N., Kang, L. Q., Müller, F., Zobel, M., DeBeer, S., Leitner, W., Bordet, A. (2024). Design and Understanding of Adaptive Hydrogenation Catalysts Triggered by the H2CO2-Formic Acid Equilibrium. Journal of the American Chemical Society, 146 (44), 30057-30067. doi:10.1021/jacs.4c06765.
Zhang, B. F., Joyce, J. P., Wolford, N. J., Brennessel, W. W., DeBeer, S., Neidig, M. L. (2024). Unusual S=1 Four-Coordinate Fe(IV) Complexes Supported by Bisamide Ligands: Syntheses, Characterization, and Electronic Structures. Angewandte Chemie-International Edition, 63 (36). doi:10.1002/anie.202405113.
Zenner, J., Tran, K., Kang, L. Q., Kinzel, N. W., Werle, C., DeBeer, S., Bordet, A., Leitner, W. (2024). Synthesis, Characterization, and Catalytic Application of Colloidal and Supported Manganese Nanoparticles. Chemistry-a European Journal, 30 (25). doi:10.1002/chem.202304228.
Wilson, D. W. N., Fataftah, M. S., Mathe, Z., Mercado, B. Q., DeBeer, S., Holland, P. L. (2024). Three-Coordinate Nickel and Metal-Metal Interactions in a Heterometallic Iron-Sulfur Cluster. Journal of the American Chemical Society, 146 (6), 4013-4025. doi:10.1021/jacs.3c12157.
Wahl, I. M., Sengupta, K., van Gastel, M., Decamps, L., DeBeer, S. (2024). Understanding the P-Cluster of Vanadium Nitrogenase: an EPR and XAS Study of the Holo vs. Apo Forms of the Enzyme. ChemBioChem. e202400833. doi:10.1002/cbic.202400833.
Van Stappen, C., Van Kuiken, B. E., Mörtel, M., Ruotsalainen, K. O., Maganas, D., Khusniyarov, M. M., DeBeer, S. (2024). Correlating Valence and 2p3d RIXS Spectroscopies: A Ligand-Field Study of Spin-Crossover Iron(II). Inorganic Chemistry, 63 (16), 7386-7400. doi:10.1021/acs.inorgchem.4c00435.
Tamhankar, A., Wensien, M., Jannuzzi, S. A. V., Chatterjee, S., Lassalle-Kaiser, B., Tittmann, K., DeBeer, S. (2024). In Solution Identification of the Lysine-Cysteine Redox Switch with a NOS Bridge in Transaldolase by Sulfur K-Edge X-ray Absorption Spectroscopy. Journal of Physical Chemistry Letters, 15 (16), 4263-4267. doi:10.1021/acs.jpclett.4c00484.
Tagliavini, V., Duan, P. C., Chatterjee, S., Ferretti, E., Dechert, S., Demeshko, S., Kang, L. Q., Peredkov, S., DeBeer, S., Meyer, F. (2024). Cooperative Sulfur Transformations at a Dinickel Site: A Metal Bridging Sulfur Radical and Its H-Atom Abstraction Thermochemistry. Journal of the American Chemical Society, 146 (33), 23158-23170. doi:10.1021/jacs.4c05113.
Souilah, C., Jannuzzi, S. A. V., Becker, F. J., Demirbas, D., Jenisch, D., Ivlev, S., Xie, X. L., Peredkov, S., Lichtenberg, C., DeBeer, S., Casitas, A. (2024). Synthesis of Iron(IV) Alkynylide Complexes and Their Reactivity to Form 1,3-Diynes. Angewandte Chemie-International Edition. doi:10.1002/anie.202421222.
Salati, M., Dorchies, F., Wang, J. W., Ventosa, M., González-Carrero, S., Bozal-Ginesta, C., Holub, J., Rüdiger, O., DeBeer, S., Gimbert-Suriñach, C., Durrant, J. R., Ertem, M. Z., Gil-Sepulcre, M., Llobet, A. (2024). Covalent Triazine-Based Frameworks with Ru-tda Based Catalyst Anchored via Coordination Bond for Photoinduced Water Oxidation. Small. doi:10.1002/smll.202406375.
Roemelt, C., Peredkov, S., Neese, F., Roemelt, M., DeBeer, S. (2024). Valence-to-core X-ray emission spectroscopy of transition metal tetrahalides: mechanisms governing intensities. Physical Chemistry Chemical Physics, 26 (29), 19960-19975. doi:10.1039/d4cp00967c.
Rice, D. B., Wong, D. N., Weyhermüller, T., Neese, F., DeBeer, S. (2024). The spin-forbidden transition in iron(IV)-oxo catalysts relevant to two-state reactivity. Science Advances, 10 (26). doi:10.1126/sciadv.ado1603.
Reichle, S., Kang, L. Q., Demirbas, D., Weidenthaler, C., Felderhoff, M., DeBeer, S., Schüth, F. (2024). Mechanocatalytic Synthesis of Ammonia: State of the Catalyst During Reaction and Deactivation Pathway. Angewandte Chemie-International Edition, 63 (14). doi:10.1002/anie.202317038.
Rana, A., Peredkov, S., Behrens, M., DeBeer, S. (2024). Probing the Local Environment in Potassium Salts and Potassium-Promoted Catalysts by Potassium Valence-to-Core X-ray Emission Spectroscopy. Inorganic Chemistry, 63 (35), 16217-16223. doi:10.1021/acs.inorgchem.4c02069.
Puja De, G., Singh, K. K., Jannuzzi, S. A. V., Mohanty, A., Velasco, L., Kulbir, Kumar, P., Marco, J. F., Nagarajan, K., Pecharromán, C., Rodríguez-Pascual, P. M., DeBeer, S., Moonshiram, D., Sen Gupta, S., Dasgupta, J. (2024). Trapping an Elusive Fe(IV)-Superoxo Intermediate Inside a Self-Assembled Nanocage in Water at Room Temperature. J. Am. Chem. Soc., 146 (31), 21729-21741. doi:10.1021/jacs.4c05849.
Porte, V., Milunovic, M. N. M., Knof, U., Leischner, T., Danzl, T., Kaiser, D., Gruene, T., Zalibera, M., Jelemenska, I., Bucinsky, L., Jannuzzi, S. A. V., DeBeer, S., Novitchi, G., Maulide, N., Arion, V.B. (2024). Chemical and Redox Noninnocence of Pentane - 2,4- dione Bis(S- methylisothiosemicarbazone) in Cobalt Complexes and Their Application in Wacker-Type Oxidation. JACS Au, 4 (3), 1166-1183. doi:10.1021/jacsau.4c00005.
Peredkov, S., Pereira, N., Grötzsch, D., Hendel, S., Wallacher, D., DeBeer S. (2024). PINK: a tender X-ray beamline for X-ray emission spectroscopy. Journal of Synchrotron Radiation, 31, 622-634. doi:10.1107/s1600577524002200.
Munzone, A., Pujol, M., Tamhankar, A., Joseph, C., Mazurenko, I., Réglier, M., Jannuzzi, S. A. V., Royant, A., Sicoli, G., DeBeer, S., Orio, M., Simaan, A. J., Decroos, C. (2024). Integrated Experimental and Theoretical Investigation of Copper Active Site Properties of a Lytic Polysaccharide Monooxygenase from Serratia marcescens. Inorganic Chemistry, 63 (24), 11063-11078. doi:10.1021/acs.inorgchem.4c00602.
Luo, Z. M., Wang, J. W., Nikolaou, V., Garcia-Padilla, E., Gil-Sepulcre, M., Benet-Buchholz, J., Rüdiger, O., DeBeer, S., Maseras, F., Llobet, A. (2024). Molecular Hybrid Materials for Selective CO2 Electroreduction to Multicarbon Products. Advanced Energy Materials, 14 (43). doi:10.1002/aenm.202402070.
Le, L. N. V., Joyce, J. P., Oyala, P. H., DeBeer, S., Agapie, T. (2024). Highly Activated Terminal Carbon Monoxide Ligand in an Iron-Sulfur Cluster Model of FeMco with Intermediate Local Spin State at Fe. Journal of the American Chemical Society, 146 (8), 5045-5050. doi:10.1021/jacs.3c12025.
Kumar, A., Gil-Sepulcre, M., Lee, J. S., Bui, V. Q., Wang, Y., Rüdiger, O., Kim, M. G., DeBeer, S., Tüysüz, H. (2024). Iridium Single-Atom-Ensembles Stabilized on Mn-Substituted Spinel Oxide for Durable Acidic Water Electrolysis. Advanced Materials, 36 (46). doi:10.1002/adma.202401648.
Kumar, A., Gil-Sepulcre, M., Fandré, J. P., Rüdiger, O., Kim, M. G., DeBeer, S., Tüysüz, H. (2024). Regulating Local Coordination Sphere of Ir Single Atoms at the Atomic Interface for Efficient Oxygen Evolution Reaction. Journal of the American Chemical Society, 146 (48), 32953-32964. doi:10.1021/jacs.4c08847.
Keilwerth, M., Mao, W. Q., Malischewski, M., Jannuzzi, S. A. V., Breitwieser, K., Heinemann, F. W., Scheurer, A., DeBeer, S., Munz, D., Bill, E., Meyer, K. (2024). The synthesis and characterization of an iron(VII) nitrido complex. Nature Chemistry, 16 (4). doi:10.1038/s41557-023-01418-4.
He, B., Hosseini, P., Escalera-López, D., Schulwitz, J., Rüdiger, O., Hagemann, U., Heidelmann, M., DeBeer, S., Muhler, M., Cherevko, S., Tschulik, K., Li, T. (2024). Effects of Dynamic Surface Transformation on the Activity and Stability of Mixed Co-Mn Cubic Spinel Oxides in the Oxygen Evolution Reaction in Alkaline Media. Advanced Energy Materials. doi:10.1002/aenm.202403096.
Hahn, A. W., Zsombor-Pindera, J., Kennepohl, P., DeBeer, S. (2024). Introducing SpectraFit: An Open-Source Tool for Interactive Spectral Analysis. Acs Omega, 9 (22), 23252-23265. doi:10.1021/acsomega.3c09262.
Geoghegan, B. L., Bilyj, J. K., Bernhardt, P. V., DeBeer, S., Cutsail, G. E., III (2024). X-ray absorption and emission spectroscopy of N2S2 Cu(ii)/(iii) complexes. Dalton Transactions, 53 (18), 7828-7838. doi:10.1039/d4dt00085d.
Fataftah, M. S., Wilson, D. W. N., Mathe, Z., Gerard, T. J., Mercado, B. Q., DeBeer, S., Holland, P. L. (2024). Inserting Three-Coordinate Nickel into 4Fe-4S Clusters. ACS Central Science, 10 (10), 1910-1919. doi:10.1021/acscentsci.4c00985.
Debnath, S., Laxmi, S., Stepanic, O. M., Quek, S. Y., van Gastel, M., DeBeer, S., Kramer, T., England, J. (2024). A Four-Coordinate End-On Superoxocopper(II) Complex: Probing the Link between Coordination Number and Reactivity. Journal of the American Chemical Society, 146 (34), 23704-23716. doi:10.1021/jacs.3c12268.
Chen, Z., Fan, Q., Wang, X., Kang, L., Wan, W., Avaro, J. T., Zhang, S., Scheu, C., Zhou, J., DeBeer, S., Heumann, S., Huang, M., Jiang, H., Cölfen, H. (2024). Mechanistic insights into the formation of hydroxides with unconventional coordination environments to achieve their cost-effective synthesis. National Science Review, nwae427. doi: 10.1093/nsr/nwae427.
Chen, S. L., Jelic, J., Rein, D., Najafishirtari, S., Schmidt, F. P., Girgsdies, F., Kang, L. Q., Wandzilak, A., Rabe, A., Doronkin, D. E., Wang, J. H., Ortega, K. F., DeBeer, S., Grunwaldt, J. D., Schlögl, R., Lunkenbein, T., Studt, F., Behrens, M. (2024). Highly loaded bimetallic iron-cobalt catalysts for hydrogen release from ammonia. Nature Communications, 15 (1). doi:10.1038/s41467-023-44661-6.
Castillo, R. G., Van Kuiken, B. E., Weyhermüller, T., DeBeer, S. (2024). Experimentally Assessing the Electronic Structure and Spin-State Energetics in MnFe Dimers Using 1s3p Resonant Inelastic X-ray Scattering. Inorganic Chemistry, 63 (39), 18468-18483. doi:10.1021/acs.inorgchem.4c01538.
2023
Zhang, Y. Y., El Sayed, S., Kang, L. Q., Sanger, M., Wiegand, T., Jessop, P. G., DeBeer, S., Bordet, A., Leitner, W. (2023). Adaptive Catalysts for the Selective Hydrogenation of Bicyclic Heteroaromatics using Ruthenium Nanoparticles on a CO2-Responsive Support. Angewandte Chemie-International Edition, 62 (48). doi:10.1002/anie.202311427.
Yogendra, S., Wilson, D. W. N., Hahn, A. W., Weyhermüller, T., Van Stappen, C., Holland, P., DeBeer, S. (2023). Sulfur-Ligated 2Fe-2C Clusters as Synthetic Model Systems for Nitrogenase. Inorganic Chemistry, 62 (6), 2663-2671. doi:10.1021/acs.inorgchem.2c03693.
Wandzilak, A., Grubel, K., Skubi, K. L., McWilliams, S. F., Bessas, D., Rana, A., Hugenbruch, S., Dey, A., Holland, P. L., DeBeer, S. (2023). Mossbauer and Nuclear Resonance Vibrational Spectroscopy Studies of Iron Species Involved in N-N Bond Cleavage. Inorganic Chemistry, 62 (45), 18449-18464. doi:10.1021/acs.inorgchem.3c02594.
Velasco, L., Liu, C. M., Zhang, X. Y., Grau, S., Gil-Sepulcre, M., Gimbert-Suriñach, C., Picón, A., Llobet, A., DeBeer, S., Moonshiram, D. (2023). Mapping the Ultrafast Mechanistic Pathways of Co Photocatalysts in Pure Water through Time-Resolved X-ray Spectroscopy. ChemSusChem, 16 (21), e202300719. doi:10.1002/cssc.202300719.
Van Stappen, C., Benediktsson, B., Rana, A., Chumakov, A., Yoda, Y., Bessas, D., Decamps, L., Bjornsson, R., DeBeer, S. (2023). Structural correlations of nitrogenase active sites using nuclear resonance vibrational spectroscopy and QM/MM calculations. Faraday Discussions, 243 (0), 253-269. doi:10.1039/d2fd00174h.
Sodreau, A., Zahedi, H. G., Dervisoglu, R., Kang, L. Q., Menten, J., Zenner, J., Terefenko, N., DeBeer, S., Wiegand, T., Bordet, A., Leitner, W. (2023). A Simple and Versatile Approach for the Low-Temperature Synthesis of Transition Metal Phosphide Nanoparticles from Metal Chloride Complexes and P(SiMe3)3. Advanced Materials, 35 (49). doi:10.1002/adma.202306621.
Pielsticker, L., Nicholls, R. L., DeBeer, S., Greiner, M. (2023). Convolutional neural network framework for the automated analysis of transition metal X-ray photoelectron spectra. Analytica Chimica Acta, 1271. doi:10.1016/j.aca.2023.341433.
Pang, Y., Nöthling, N., Leutzsch, M., Kang, L. Q., Bill, E., van Gastel, M., Reijerse, E., Goddard, R., Wagner, L., SantaLucia, D., DeBeer, S., Neese, F., Cornella, J. (2023). Synthesis and isolation of a triplet bismuthinidene with a quenched magnetic response. Science, 380 (6649), 1043-1048. doi:10.1126/science.adg2833.
Martini, M. A., Bikbaev, K., Pang, Y. J., Lorent, C., Wiemann, C., Breuer, N., Zebger, I., DeBeer, S., Span, I., Bjornsson, R., Birrell, J. A., Rodríguez-Maciá, P. (2023). Binding of exogenous cyanide reveals new active-site states in FeFe hydrogenases. Chemical Science, 14 (11), 2826-2838. doi:10.1039/d2sc06098a.
Mao, W. Q., Zhang, Z. H., Fehn, D., Jannuzzi, S. A. V., Heinemann, F. W., Scheurer, A., van Gastel, M., DeBeer, S., Munz, D., Meyer, K. (2023). Synthesis and Reactivity of a Cobalt-Supported Singlet Nitrene. Journal of the American Chemical Society, 145 (25), 13650-13662. doi:10.1021/jacs.3c01478.
Liu, Y., Chatterjee, S., Cutsail, G. E., III, Peredkov, S., Gupta, S. K., Dechert, S., DeBeer, S., Meyer, F. (2023). Cu4S Cluster in "0-Hole" and "1-Hole" States: Geometric and Electronic Structure Variations for the Active CuZ* Site of N2O Reductase. Journal of the American Chemical Society. doi:10.1021/jacs.3c04893.
Kovel, C. B., Darmon, J. M., Stieber, S. C. E., Pombar, G., Pabst, T. P., Theis, B., Turner, Z. R., Üngör, Ö., Shatruk, M., DeBeer, S., Chirik, P. J. (2023). Bimolecular Reductive Elimination of Ethane from Pyridine(diimine) Iron Methyl Complexes: Mechanism, Electronic Structure, and Entry into 2+2 Cycloaddition Catalysis. Journal of the American Chemical Society. doi:10.1021/jacs.2c10547.
Keilwerth, M., Mao, W. Q., Jannuzzi, S. A. V., Grunwald, L., Heinemann, F. W., Scheurer, A., Sutter, J., DeBeer, S., Munz, D., Meyer, K. (2023). From Divalent to Pentavalent Iron Imido Complexes and an Fe(V) Nitride via N-C Bond Cleavage. Journal of the American Chemical Society, 145 (2), 873-887. doi:10.1021/jacs.2c09072.
Hou, K. P., Börgel, J., Jiang, H. Z. H., SantaLucia, D. J., Kwon, H., Zhuang, H., Chakarawet, K., Rohde, R. C., Taylor, J. W., Dun, C. C., Paley, M. V., Turkiewicz, A. B., Park, J. G., Mao, H. Y., Zhu, Z. T., Alp, E. E., Zhao, J. Y., Hu, M. Y., Lavina, B., Peredkov, S., Lv, X. D., Oktawiec, J., Meihaus, K. R., Pantazis, D. A., Vandone, M., Colombo, V., Bill, E., Urban, J. J., Britt, R. D., Grandjean, F., Long, G. J., DeBeer, S., Neese, F., Reimer, J. A., Long, J. R. (2023). Reactive high-spin iron(IV)-oxo sites through dioxygen activation in a metal-organic framework. Science, 382 (6670), 547-553. doi:10.1126/science.add7417.
Hau, J. L., Kaltwasser, S., Muras, V., Casutt, M. S., Vohl, G., Claussen, B., Steffen, W., Leitner, A., Bill, E., Cutsail, G. E., DeBeer, S., Vonck, J., Steuber, J., Fritz, G. (2023). Conformational coupling of redox-driven Na+-translocation in Vibrio cholerae NADH:quinone oxidoreductase. Nature Structural & Molecular Biology, 30 (11). doi:10.1038/s41594-023-01099-0.
Hall, K. R., Joseph, C., Ayuso-Fernández, I., Tamhankar, A., Rieder, L., Skaali, R., Golten, O., Neese, F., Rohr, Å., Jannuzzi, S. A. V., DeBeer, S., Eijsink, V. G. H., Sorlie, M. (2023). A Conserved Second Sphere Residue Tunes Copper Site Reactivity in Lytic Polysaccharide Monooxygenases. Journal of the American Chemical Society. doi:10.1021/jacs.3c05342.
Ghaida, F. A., Brinkert, K., Chen, P., DeBeer, S., Hoffman, B. M., Holland, P. L., Laxmi, S., MacFarlane, D., Peters, J. C., Peters, J. W., Pickett, C. J., Seefeldt, L. C., Shylin, S. I., Stephens, I. E. L., Vincent, K. A., Wang, Q. R., Westhead, O. (2023). Enzymatic N2 activation: general discussion. Faraday Discussions, 243, 287-295. doi:10.1039/d3fd90011h.
Genoux, A., Pauly, M., Rooney, C. L., Choi, C., Shang, B., McGuigan, S., Fataftah, M. S., Kayser, Y., Suhr, S. C. B., DeBeer, S., Wang, H. L., Maggard, P. A., Holland, P. L. (2023). Well-Defined Iron Sites in Crystalline Carbon Nitride. Journal of the American Chemical Society, 145 (38), 20739-20744. doi:10.1021/jacs.3c05417.
Erbe, A., Tesch, M. F., Ruediger, O., Kaiser, B., DeBeer, S., Rabe, M. (2023). Operando studies of Mn oxide based electrocatalysts for the oxygen evolution reaction. Physical Chemistry Chemical Physics, 25 (40), 26958-26971. doi:10.1039/d3cp02384b.
Chrysina, M., Drosou, M., Castillo, R. G., Reus, M., Neese, F., Krewald, V., Pantazis, D. A., DeBeer, S. (2023). Nature of S-States in the Oxygen-Evolving Complex Resolved by High-Energy Resolution Fluorescence Detected X-ray Absorption Spectroscopy. Journal of the American Chemical Society, 145 (47), 25579-25594. doi:10.1021/jacs.3c06046.
Caserta, G., Hartmann, S., Van Stappen, C., Karafoulidi-Retsou, C., Lorent, C., Yelin, S., Keck, M., Schoknecht, J., Sergueev, I., Yoda, Y., Hildebrandt, P., Limberg, C., DeBeer, S., Zebger, I., Frielingsdorf, S., Lenz, O. (2023). Stepwise assembly of the active site of NiFe-hydrogenase. Nature Chemical Biology, 19 (4), 498. doi:10.1038/s41589-022-01226-w.
Anandaraj, S. J. L., Kang, L. Q., DeBeer, S., Bordet, A., Leitner, W. (2023). Catalytic Hydrogenation of CO2 to Formate Using Ruthenium Nanoparticles Immobilized on Supported Ionic Liquid Phases. Small, 19 (18). doi:10.1002/smll.202206806.
2022
Yu, M. Q., Weidenthaler, C., Wang, Y., Budiyanto, E., Sahin, E. O., Chen, M. M., DeBeer, S., Rüdiger, O., Tüysüz, H. (2022). Surface Boron Modulation on Cobalt Oxide Nanocrystals for Electrochemical Oxygen Evolution Reaction. Angewandte Chemie-International Edition, 61 (42). doi:10.1002/anie.202211543.
Xiang, W. K., Yang, N. T., Li, X. P., Linnemann, J., Hagemann, U., Ruediger, O., Heidelmann, M., Falk, T., Aramini, M., DeBeer, S., Muhler, M., Tschulik, K., Li, T. (2022). 3D atomic-scale imaging of mixed Co-Fe spinel oxide nanoparticles during oxygen evolution reaction. Nature Communications, 13 (1). doi:10.1038/s41467-021-27788-2.
Van Stappen, C., Jiménez-Vicente, E., Pérez-González, A., Yang, Z. Y., Seefeldt, L. C., DeBeer, S., Dean, D. R., Decamps, L. (2022). A conformational role for NifW in the maturation of molybdenum nitrogenase P-cluster. Chemical Science, 13 (12), 3489-3500. doi:10.1039/d1sc06418e.
Souilah, C., Jannuzzi, S. A. V., Demirbas, D., Ivlev, S., Swart, M., DeBeer, S., Casitas, A. (2022). Synthesis of FeIII and FeIV Cyanide Complexes Using Hypervalent Iodine Reagents as Cyano-Transfer One-Electron Oxidants. Angewandte Chemie-International Edition, 61 (22), e202201699. doi:10.1002/anie.202201699.
Sisodiya-Amrute, S., Van Stappen, C., Rengshausen, S., Han, C. H., Sodreau, A., Weidenthaler, C., Tricard, S., DeBeer, S., Chaudret, B., Bordet, A., Leitner, W. (2022). Bimetallic MxRu100-x nanoparticles (M = Fe, Co) on supported ionic liquid phases (MxRu100-x @SILP) as hydrogenation catalysts: Influence of M and M: Ru ratio on activity and selectivity. Journal of Catalysis, 407, 141-148. doi:10.1016/j.jcat.2022.01.030.
Mao, W. Q., Fehn, D., Heinemann, F. W., Scheurer, A., van Gastel, M., Jannuzzi, S. A., DeBeer, S., Munz, D., Meyer, K. (2022). Umpolung in a Pair of Cobalt(III) Terminal Imido/Imidyl Complexes. Angewandte Chemie-International Edition, 61 (36). doi:10.1002/anie.202206848.
Levin, N., Casadevall, C., Cutsail, G. E., Lloret-Fillol, J., DeBeer, S., Rüdiger, O. (2022). XAS and EPR in Situ Observation of Ru(V) Oxo Intermediate in a Ru Water Oxidation Complex**. Chemelectrochem, 9 (3). doi:10.1002/celc.202101271.
Jedrzkiewicz, D., Mai, J., Langer, J., Mathe, Z., Patel, N., DeBeer, S., Harder, S. (2022). Access to a Labile Monomeric Magnesium Radical by Ball-Milling. Angewandte Chemie-International Edition, 61 (15). doi:10.1002/anie.202200511.
Henthorn, J. T., DeBeer, S. (2022). Selenium Valence-to-Core X-ray Emission Spectroscopy and Kβ HERFD X-ray Absorption Spectroscopy as Complementary Probes of Chemical and Electronic Structure. Inorganic Chemistry, 61 (6), 2760-2767. doi:10.1021/acs.inorgchem.1c02802.
Henthorn, J. T., Cutsail, G. E., Weyhermüller, T., DeBeer, S. (2022). Stabilization of intermediate spin states in mixed-valent diiron dichalcogenide complexes. Nature Chemistry, 14 (3), 328. doi:10.1038/s41557-021-00853-5.
Geoghegan, B. L., Liu, Y., Peredkov, S., Dechert, S., Meyer, F., DeBeer, S., Cutsail, G. E. (2022). Combining Valence-to-Core X-ray Emission and Cu K-edge X-ray Absorption Spectroscopies to Experimentally Assess Oxidation State in Organometallic Cu(I)/(II)/(III) Complexes. Journal of the American Chemical Society, 144 (6), 2520-2534. doi:10.1021/jacs.1c09505.
Decamps, L., Rice, D. B., DeBeer, S. (2022). An Fe6C Core in All Nitrogenase Cofactors. Angewandte Chemie-International Edition, 61 (41). doi:10.1002/anie.202209190.
Czastka, K., Oughli, A. A., Rüdiger, O., DeBeer, S. (2022). Enzymatic X-ray absorption spectroelectrochemistry. Faraday Discussions, 234, 214-231. doi:10.1039/d1fd00079a.
Cutsail, G. E., DeBeer, S. (2022). Challenges and Opportunities for Applications of Advanced X-ray Spectroscopy in Catalysis Research. Acs Catalysis, 12 (10), 5864-5886. doi:10.1021/acscatal.2c01016.
Cutsail, G. E., III, Banerjee, R., Rice, D. B., Stepanic, O. M., Lipscomb, J. D., DeBeer, S. (2022). Determination of the iron(IV) local spin states of the Q intermediate of soluble methane monooxygenase by Kβ X-ray emission spectroscopy. Journal of Biological Inorganic Chemistry, 27 (6), 573-582. doi:10.1007/s00775-022-01953-4.
Cutsail, G., III, Schott-Verdugo, S., Müller, L., DeBeer, S., Groth, G., Gohlke, H. (2022). Spectroscopic and QM/MM studies of the Cu(I) binding site of the plant ethylene receptor ETR1. Biophysical Journal, 121 (20), 3862-3873. doi:10.1016/j.bpj.2022.09.007.
Chatterjee, S., Harden, I., Bistoni, G., Castillo, R. G., Chabbra, S., van Gastel, M., Schnegg, A., Bill, E., Birrell, J. A., Morandi, B., Neese, F., DeBeer, S. (2022). A Combined Spectroscopic and Computational Study on the Mechanism of Iron-Catalyzed Aminofunctionalization of Olefins Using Hydroxylamine Derived N-O Reagent as the "Amino" Source and "Oxidant". Journal of the American Chemical Society, 144 (6), 2637-2656. doi:10.1021/jacs.1c11083.
Bowker, M., DeBeer, S., Dummer, N. F., Hutchings, G. J., Scheffler, M., Schüth, F., Taylor, S. H., Tüysüz, H. (2022). Advancing Critical Chemical Processes for a Sustainable Future: Challenges for Industry and the Max Planck-Cardiff Centre on the Fundamentals of Heterogeneous Catalysis (FUNCAT). Angewandte Chemie-International Edition, 61 (50), e202209016. doi:10.1002/anie.202209016.
Anilkumar, A., Ash, P., Chakravarty, A. R., Comba, P., DeBeer, S., Dey, A., Draksharapu, A., Goswami, D., Itoh, S., Karlin, K., Lakshmi, K. V., Mazumdar, S., Pantazis, D., Parker, D., Que, L. C., Rajaraman, G., Rath, S. P., Sastri, C., Sen Gupta, S., Solomon, E. I. (2022). Electron transfer, spectroscopy and theory: general discussion. Faraday Discussions, 234 (0), 245-263. doi:10.1039/d2fd90013k.
Alkan, B., Braun, M., Landrot, G., Rüdiger, O., Andronescu, C., DeBeer, S., Schulz, C., Wiggers, H. (2022). Spray-flame-synthesized Sr- and Fe-substituted LaCoO3 perovskite nanoparticles with enhanced OER activities. Journal of Materials Science, 57 (40), 18923-18936. doi:10.1007/s10853-022-07738-z.
Aldous, L., Comba, P., DeBeer, S., Dey, A., Draksharapu, A., Duboc, C., Itoh, S., Karlin, K., Kundu, S., Domene, R. L., Maréchal, J. D., Mazumdar, S., Mukherjee, R., Parker, D., Pordea, A., Que, L. C., Rath, S. P., Sadler, P., Sastri, C., Schindler, S., Schünemann, V., Sen Gupta, S., Solomon, E. I., Stack, T. D. P. (2022). Small molecule activation and synthetic analogues: general discussion. Faraday Discussions, 234 (0), 129-142. doi:10.1039/d2fd90012b.
Preise
- 2024 Michael Lappert Lectureship Award
- 2023 Glenn T. Seaborg Lectureship, University of California Berkeley
- 2022 R.J.P. Williams Lectureship, Oxford University
- 2022 Malcom H. Chisholm Lecturer, The Ohio State University
- 2021 Fellow of the Royal Society of Chemistry
- 2019 European Research Council Synergy Grant Awardee
- 2016 Inorganic Chemistry Lectureship Award
- 2015 Society of Biological Inorganic Chemistry, Early Career Award
- 2013 European Research Council Consolidator Grant Awardee
- 2012 Kavli Fellow, U.S. National Academy of Sciences
- 2011-2013 Alfred P. Sloan Research Fellow
Abteilungsmitglieder
Sekretariat
Valerie EstersGruppenleiter*innen
Dr. Rebeca Gomez CastilloDr. Sergey Peredkov
Dr. Christina Römelt
Dr. Olaf Rüdiger
Dr. Kushal Sengupta
Dr. Thomas Weyhermüller
Projektleiter*innen
Dr. Yves KayserDr. Sergio Augusto Venturinelli Jannuzzi
Gruppen
Projekte
Anorganische Spektroskopie
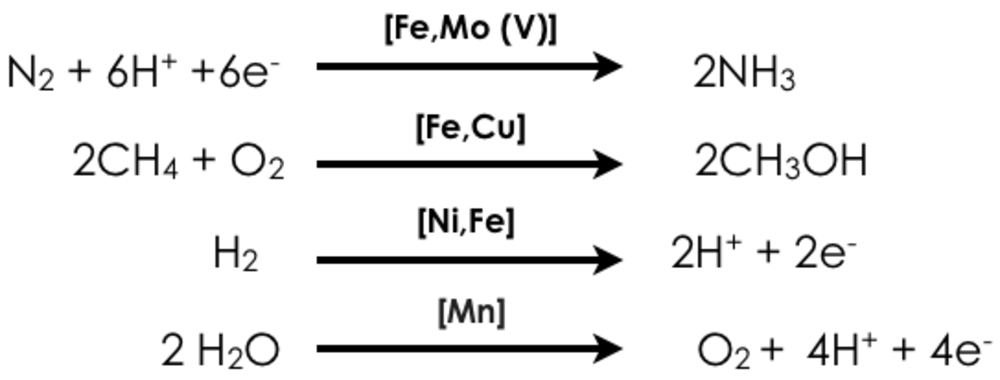
Unsere Abteilung ist auf die Entwicklung und Anwendung fortschrittlicher röntgenspektroskopischer Methoden fokussiert, um Vorgänge in der chemischen und biologischen Katalyse zu verstehen. Wir sind an der Entwicklung von statischen und zeitaufgelösten Verfahren zur Erforschung der elektronischen Struktur von Übergangsmetallverbindungen interessiert, aber auch an der Entwicklung von zweidimensionalen Verfahren, die eine erhöhte Selektivität ermöglichen. Angetrieben werden wir dabei durch drängende Fragen der Energieforschung. Wie können etwa starke chemische Bindungen durch leicht verfügbare Metalle, wie z.B. Eisen und Kupfer, aktiviert werden? In diesem Zusammenhang konzentrieren wir uns auf vier Metall-katalysierte Reaktionen:
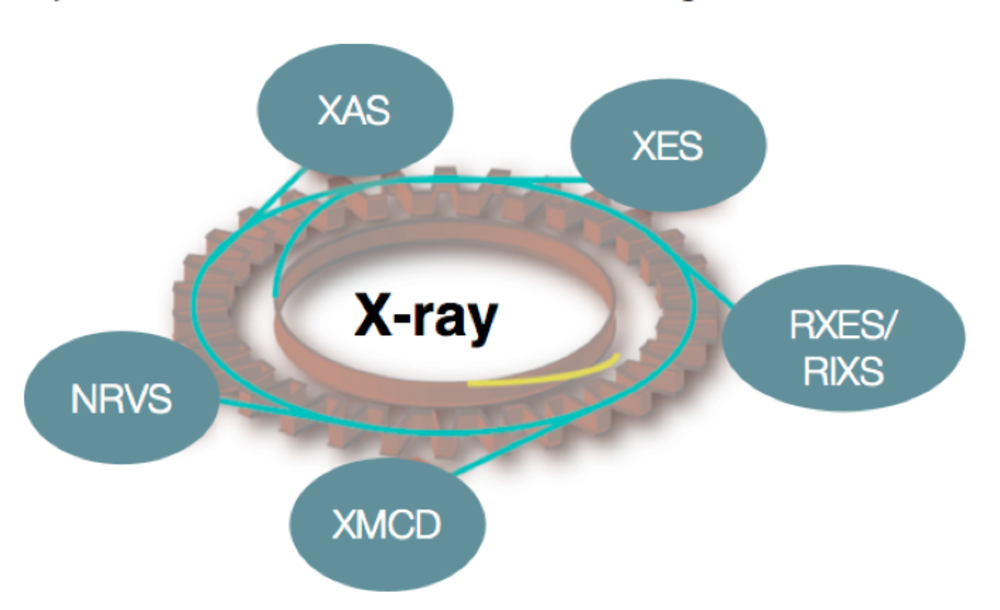
In den oben dargestellten Reaktionen sind sowohl biologische (homogene) als auch heterogene Katalysatoren vertreten, die die Umsetzungen mit unterschiedlicher Effizienz und manchmal in mehreren Schritten vorantreiben (z.B. bei der industriellen Methan Oxidation). Wir sind daran interessiert, die elektronische Struktur der Katalysatoren und die Natur der Intermediate im Reaktionszyklus zu verstehen. Im Idealfall ist das so gewonnene Wissen die Basis zur Entwicklung neuer, verbesserter Katalysatoren. Unser Ansatz nutzt röntgenbasierte spektroskopische Methoden, die sowohl resonante (RXES, RIXS), als auch nicht resonante (XES) Röntgenemissions-, oder Röntgenabsorptions-Vorgänge (XAS) analysieren. Zusätzlich werden Röntgen-Circulardichroismus (XMCD), und kernresonante Schwingungsspektroskopie (NRVS) genutzt (Abb. 1). Neben unseren Synchrotron-basierten Aktivitäten entwickeln wir auch Instrumente zur hausinternen Röntgenspektroskopie. Die Kombination der verschiedenen Methoden ermöglicht es, Informationen über den Oxidationszustand, den Spinzustand und die lokale chemische Umgebung des katalytisch aktiven Metallzentrums zu gewinnen. Unsere Studien werden durch weitere Messungen wie UV-vis, EPR, Raman und Mössbauerspektroskopie sowie durch moderne quantenchemische Rechnungen ergänzt, um elektronische und strukturelle Änderungen des katalytischen Systems zu untersuchen.
1. Methodenentwicklung
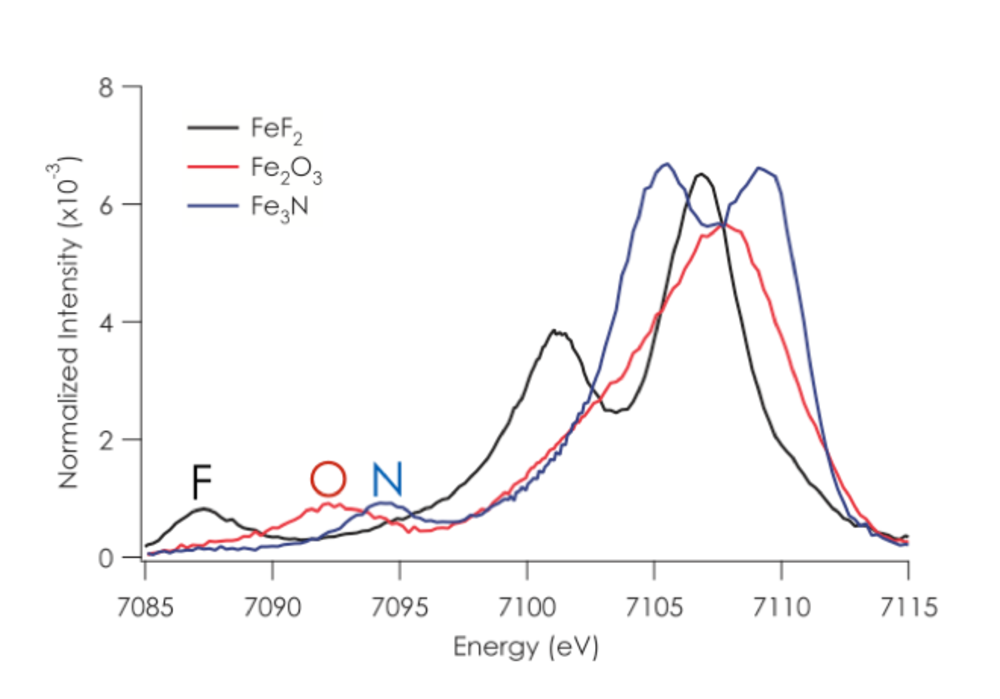
1.1. Valenz XES. In der Vergangenheit hat sich unsere Arbeitsgruppe darauf konzentriert, den vollständigen Informationsgehalt der Röntgenemissionen von Valenzübergängen (XES) zur Untersuchung von biologischen Katalysatoren nutzbar zu machen.1-12 Bei einer Valenz XES Messung werden zunächst 1s Elektronen am Metall herausgeschlagen und die daraufhin folgenden Fluoreszenzemissionen aufgezeichnet, die beim Auffüllen der 1s Orbitale mit Valenzelektronen auftreten. Auf diese Weise liefern Valenz XES Spektren ein Abbild der Ionisationspotentiale der gebundenen Liganden, die eine starke Abhängigkeit von der Art des Elements (z.B. C, N, O) und des Portionierungszustandes (O2-, OH-, H2O) liefern (Abb. 2).
Ein bemerkenswertes Beispiel für die erfolgreiche Anwendung der Methode ist etwa die Identifizierung eines zentralen Kohlenstoffatoms im FeMoco Cluster der Nitrogenase.8 Dieses zentrale Atom hatte sich jahrzehntelang einer Identifizierung durch andere Verfahren entzogen und verdeutlicht somit die Leistungsfähigkeit der XES. Neuere Studien der Gruppe Anorganische Spektroskopie beschäftigen sich mit der Nutzung der XES zur Aufklärung der Biosynthese von Metallokofaktoren und der atomaren Zusammensetzung des FeVco in Vanadium-Nitrogenase.7,13,14
Valenz XES ist nicht nur empfindlich bezüglich der Identität eines Liganden, sondern auch in welchem Maße dieser aktiviert ist (Schwächung der Bindung). Beispielsweise konnten in XES Spektren von Fe-N2 Komplexen bestimmte Merkmale festgestellt werden, die den Bereich des Spektrums betreffen, der mit der Interaktion des N2 2s2s s* Orbitals mit dem Eisenzentrum korreliert ist. Wird die N-N Bindung beim Übergang von der N-N Dreifachbindung zum Nitrid hin länger, nimmt die Energie des Übergangs um etwa 2 eV ab. Dies zeigt, dass die Fe Valenz XES eine ideale spektrale Sonde zur Untersuchung der N-N Bindungsspaltung (oder die Spaltung anderer zweiatomiger Liganden) am Eisen (oder anderer Metalle) ist.
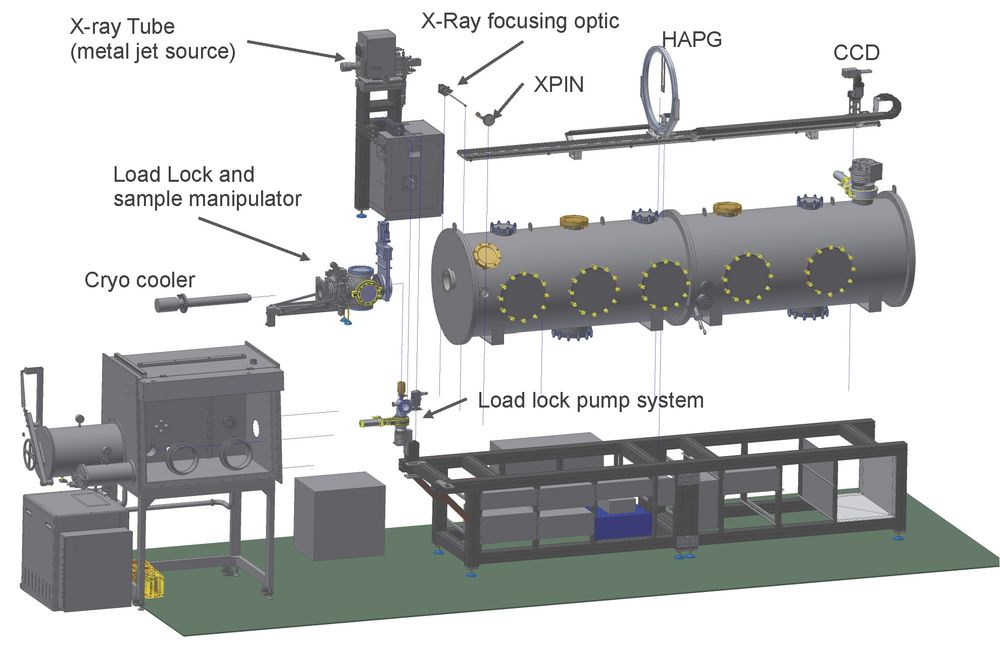
Zu diesem Zweck entwickeln wir die dispersive zeitaufgelöste Valenz XES zum Studium der Übergangsmetallkatalyse. Kürzlich konnte, durch Förderung mittels eines ERC Consolidator Grant (N2RED, PI: DeBeer), ein in-house Setup installiert werden, das in Zusammenarbeit mit Prof. Kanngießer an der TU Berlin entwickelt wurde. Das Instrument nutzt eine Labor-Röntgenquelle (Excillium, Metal Jet) in Kombination mit einem zylindrischen pyrolytischen Graphit Kristall (HAPG) und einem CCD Detektor um XES im Bereich 2.4-9 keV zu messen (Abb. 3).
Dieses einzigartige in-house Instrument reduziert den Bedarf für Messzeit am Synchrotron, da es ideale Möglichkeiten bietet, konzentrierte Proben zu untersuchen und aufwendigere Messungen am Synchrotron vorzubereiten. Im Bereich der dispersiven Synchrotron-basierten XES leitet unsere Abteilung auch die Entwicklung der PINK Beam Line am Energy Materials In-situ Laboratory in Berlin. PINK eröffnet uns auch die Möglichkeit an heterometallischen Katalysatoren gleichzeitig XES Messungen bei zwei verschiedenen Wellenlängen vorzunehmen. Diese Arbeiten werden von Dr. Sergey Peredkov geleitet.
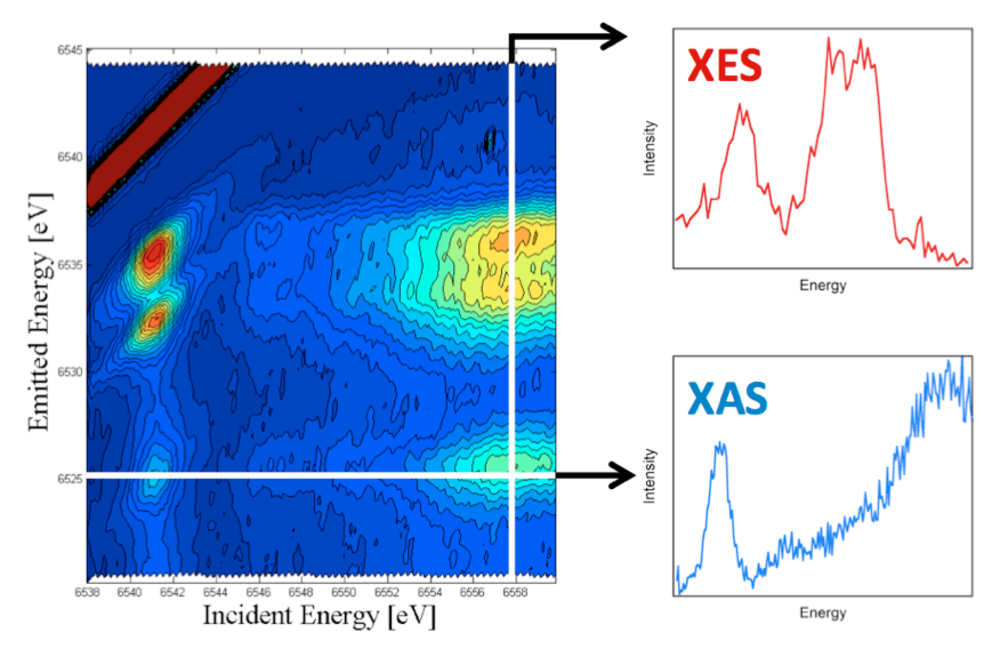
1.2. Resonante Valenz XES. Um die Selektivität der XES weiter zu verbessern, entwickeln wir die resonante Valenz XES.2 Dies ist ein zweidimensionales Verfahren bei dem man resonant ein 1s Elektron in teilweise besetzte oder unbesetzte Zustände des Absorber-Atoms anregt (das Äquivalent eines Scans der Röntgenabsorptionskante) während gleichzeitig die energetisch am höchsten liegenden Emissionsvorgänge aufgezeichnet werden (die Valenz XES). Dadurch ist man in der Lage, eine zweidimensionale Darstellung zu konstruieren, in der die einfallende Energie auf der X-Achse und die emittierte Energie auf der Y-Achse aufgetragen ist (Abb. 4). Die horizontalen Schnitte durch diese Ebene repräsentieren dann die XAS Daten bei einer gegebenen Emissionsenergie und können auch als "ligandenselektive XAS“ bezeichnet werden. Die vertikalen Schnitte zeigen dann die XES Daten bei einer gegebenen einfallenden Energie (Valenz RXES). Wir glauben, dass dieser Ansatz ein hervorragendes Mittel darstellt um XAS Daten verschiedener Metall-Ligand Wechselwirkungen in komplexen Materialen zu messen.
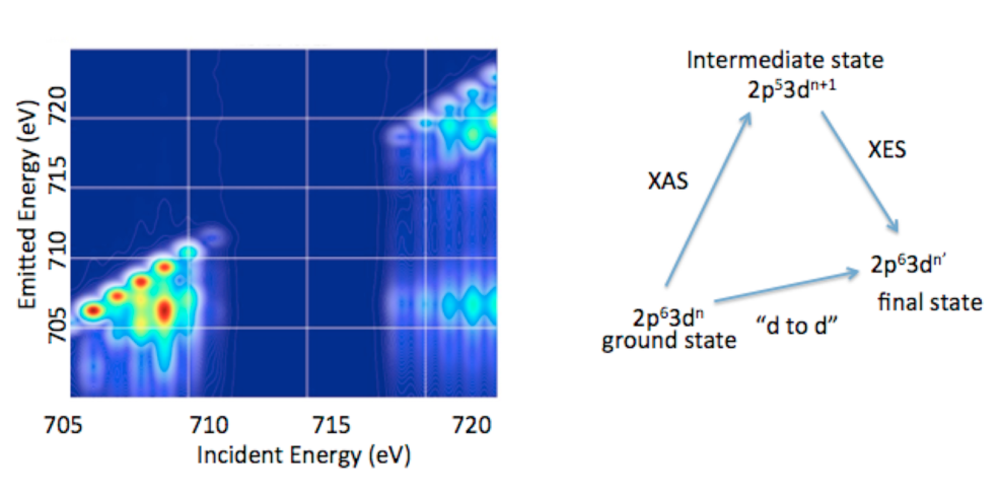
1.3. 2p3d RIXS. Zusätzlich zur Valenz REXS entwickeln wir Verfahren, um den vollständigen Informationsgehalt von Übergangsmetall 2p3d RXES, oft auch 2p3d RIXS genannt, zu erschließen.15
2p3d RIXS ist mit dem Dipol-erlaubten Übergang des 2p63dn Grundzustandes in den 2p53dn+1 Zwischenzustand verknüpft, der dann wieder, Dipol-erlaubt, in einen finalen 2p63dn Zustand relaxiert (Abb. 5). Somit entspricht der Übergang zwischen dem Grundzustand und dem finalen Zustand formal einem Dipol-verbotenen d-d Übergang zu dem man durch zwei Dipol-erlaubte Vorgänge gelangt. In einer 2p3d RIXS Messung bezeichnet man die Energiedifferenz zwischen dem Grundzustand und dem finalen Zustand als “Energy Tranfer“ Achse, welche, der Natur des Experiments entsprechend, zwischen 0-10 eV (oder 0 bis über 80.000 cm-1) angesiedelt ist. Dies bedeutet, dass die spektralen Bereiche, die sonst nicht durch optische oder infrarote Standard-Messungen zugänglich sind, hier erreichbar sind. Zudem konnte in bestimmten Fällen durch 2p3d RIXS Experimente gezeigt werden, dass Spin-verbotene Übergänge wegen der Spin-Bahn-Kopplung zum Zwischenzustand beobachtet werden können. Somit sollte es möglich sein, gewissermaßen die komplette Spin-Leiter zu vermessen und damit nie dagewesene experimentelle Einblicke in die elektronische Struktur von Übergangsmetallverbindungen zu erlangen.
2. Anwendungen
Die im vorigen Abschnitt diskutierten neu entwickelten spektroskopischen Methoden bilden eine gute Basis für Anwendungen in der biologischen und chemischen Katalyseforschung. Im Folgenden stellen wir kurz einige unserer gegenwärtigen und geplanten Forschungsthemen vor.
N2 Reduktion. Die Umwandlung von N2 in Ammoniak (NH3) ist von besonderer Bedeutung für das Leben auf der Erde. Dieser kinetisch ausgesprochen schwierige Prozess wird auf Seiten der Biologie durch das Enzym Nitrogenase bewerkstelligt und industriell mit hoher Effizienz durch den Haber-Bosch Prozess abgebildet. Chemiker haben dagegen bisher Schwierigkeiten einen homogenen Katalysator zu entwickeln der mit dem biologischen oder dem industriellen Prozess konkurrieren kann. Wir gehen davon aus, dass dieses bisherige “Unvermögen“ mit einem Mangel an Grundlagenwissen zu dieser Thematik zusammenhängt. Wie kann man die Spaltung der stärksten in der Chemie bekannten homodiatomaren Bindung effektiv bewerkstelligen? Wie wechselwirkt der metallhaltige Katalysator mit N2? Welche Intermediate werden beim Bindungsbruch des N2 Moleküls gebildet? Um diese Fragen für biologische und heterogene Katalysatoren zu beantworten, wenden wir fortschrittliche röntgenspektroskopische Methoden an. Für den biologischen Katalysator versuchen wir die komplexe elektronische Struktur des Grundzustandes, sowie die Rolle des zentralen Kohlenstoffatoms und die Funktion des Hetreometalls (Mo oder V) zu verstehen, darüber hinaus versuchen wir die Bindungsstelle des Substrats zu identifizieren. Beim heterogenen Katalysator versuchen wir die Rolle der an der Oberfläche gebildeten Eisenitrid-Funktionen, die Oxidationsstufe des aktiven Eisenzentrums und die Funktion des Kalium-Promoters zu bestimmen. Diese Fragestellungen werden hoffentlich durch die im vorhergehenden Abschnitt diskutierten fortschrittlichen spektroskopischen Methoden beantwortet.
CH4 Oxidation. Die biologische Oxidation von Methan zu Methanol durch lösliche Methanmonoxygenase ist ein Vorgang der im Zusammenhang einer Energiewirtschaft mit erneuerbaren Energien ausgesprochen interessant ist. Zurzeit forschen wir in der Gruppe Anorganische Spektroskopie intensiv daran, den Mechanismus der biologischen Methanoxidation aufzuklären und dabei vor allem die Struktur des kontrovers diskutierten Intermediates MMO-Q, welches für die Abstraktion eines Protons vom Methan zuständig ist, zu bestimmen. Durch die Anwendung von hochaufgelösten XAS Methoden konnten wir bereits neue Einblicke in die elektronische Struktur von MMO-Q gewinnen. Dies spornt uns zu weiteren “freeze-quench“ und in-situ Studien zur biologischen Methanoxidation an.
H2O Oxidation. Ähnlich wie im Fall der N2-Reduktion, sind wir sehr daran interessiert, die Mn-katalysierte Wasseroxidation sowohl im biologischen System (PSII), als auch in der heterogenen Katalyse zu verstehen. Wir nutzen auch hier unsere Methoden um Mn-Birnessite, oberflächendotierte Mn-Systeme und das aktive Zentrum des Photosystems II (Mn4Ca) zu untersuchen. Gleichzeitige und zeitaufgelöste XES an Mn- und Ca-Zentren bei zwei verschiedenen Energien wird dazu beitragen die Rolle der beiden Elemente bei der Katalyse zu entschlüsseln. Unser Ziel ist es die Faktoren die für eine O-O Bindungsbildung ausschlaggebend sind auf atomarer Grundlage zu verstehen.
H2 Produktion. Die Produktion und Aktivierung von Wasserstoff stand in den letzten Jahrzehnten im Fokus vieler Forschungsarbeiten, besonders auch in Bezug auf die Nutzung erneuerbarer Energien und von klimaneutralen Kraftstoffen. Die am weitesten verbreiteten und stabilsten Hydrogenasen enthalten im aktiven Zentrum eine [NiFe]-Einheit. Man nimmt an, dass das redox-aktive Nickel-Zentrum eine entscheidende Rolle bei der Bindung und Aktivierung von Wasserstoff spielt und viele Studien nutzten Röntgenstrukturanalyse, Elektrochemie, FTIR und EPR-Spektroskopie um die Aktivierung und den Mechanismus der Hydrogenase zu erforschen. Es wurden drei katalytisch relevante Intermediate gefunden von denen nur der sogenannte Ni-C Zustand paramagnetisch ist. Das aerob inaktivierte hydroxo-verbrückte Ni-B Intermediat und das hydrido-verbrückte Ni-C Intermediat wurden bisher als einzige Zustände strukturell gut charakterisiert. Darüber hinaus, wurde mit Hilfe von FTIR und Röntgenabsorptionsspektroskopie versucht, die beiden anderen Zustände, Ni-SI und Ni-R, zu charakterisieren. Allerdings bleiben nach wie vor viele Fragen offen, was beispielsweise die Nickel Spin-Zustände, die Natur des verbrückenden Liganden zwischen den Metallzentren im jeweiligen Redox-Zustand betrifft, oder etwa in welcher Art und an welches Metall der Wasserstoff bindet. Wir werden versuchen all diese Fragen durch eine Kombination unserer röntgenbasierten Methoden zu beantworten um schließlich den Mechanismus der biologischen Wasserstoff-Produktion zu entschlüsseln.
Referenzen
[1] Delgado-Jaime, M. U., Dible, B. R., Chiang, K. P., Brennessel, W. W., Bergmann, U., Holland, P. L., and DeBeer, S. (2011) Identification of a Single Light Atom within a Multinuclear Metal Cluster Using Valence-to-Core X-ray Emission Spectroscopy, Inorg Chem 50, 10709-10717.
[2] Hall, E. R., Pollock, C. J., Bendix, J., Collins, T. J., Glatzel, P., and DeBeer, S. (2014) Valence-to-Core-Detected X-ray Absorption Spectroscopy: Targeting Ligand Selectivity, J Am Chem Soc 136, 10076-10084.
[3] Hugenbruch, S., Shafaat, H. S., Kramer, T., Delgado-Jaime, M. U., Weber, K., Neese, F., Lubitz, W., and DeBeer, S. (2016) In search of metal hydrides: an X-ray absorption and emission study of [NiFe] hydrogenase model complexes, Phys Chem Chem Phys 18, 10688-10699.
[4] Kowalska, J., and DeBeer, S. (2015) The role of X-ray spectroscopy in understanding the geometric and electronic structure of nitrogenase, Bba-Mol Cell Res 1853, 1406-1415.
[5] Kowalska, J. K., Hahn, A. W., Albers, A., Schiewer, C. E., Bjornsson, R., Lima, F. A., Meyer, F., and DeBeer, S. (2016) X-ray Absorption and Emission Spectroscopic Studies of [L2Fe2S2](n) Model Complexes: Implications for the Experimental Evaluation of Redox States in Iron-Sulfur Clusters, Inorg Chem 55, 4485-4497.
[6] Kowalska, J. K., Lima, F. A., Pollock, C. J., Rees, J. A., and DeBeer, S. (2016) A Practical Guide to High-resolution X-ray Spectroscopic Measurements and their Applications in Bioinorganic Chemistry, Isr J Chem 56, 803-815.
[7] Lancaster, K. M., Hu, Y. L., Bergmann, U., Ribbe, M. W., and DeBeer, S. (2013) X-ray Spectroscopic Observation of an Interstitial Carbide in NifEN-Bound FeMoco Precursor, J Am Chem Soc 135, 610-612.
[8] Lancaster, K. M., Roemelt, M., Ettenhuber, P., Hu, Y. L., Ribbe, M. W., Neese, F., Bergmann, U., and DeBeer, S. (2011) X-ray Emission Spectroscopy Evidences a Central Carbon in the Nitrogenase Iron-Molybdenum Cofactor, Science 334, 974-977.
[9] Lee, N., Petrenko, T., Bergmann, U., Neese, F., and DeBeer, S. (2010) Probing Valence Orbital Composition with Iron K beta X-ray Emission Spectroscopy, J Am Chem Soc 132, 9715-9727.
[10] Pollock, C. J., and DeBeer, S. (2011) Valence-to-Core X-ray Emission Spectroscopy: A Sensitive Probe of the Nature of a Bound Ligand, J Am Chem Soc 133, 5594-5601.
[11] Pollock, C. J., and DeBeer, S. (2015) Insights into the Geometric and Electronic Structure of Transition Metal Centers from Valence-to-Core X-ray Emission Spectroscopy, Accounts Chem Res 48, 2967-2975.
[12] Pollock, C. J., Grubel, K., Holland, P. L., and DeBeer, S. (2013) Experimentally Quantifying Small-Molecule Bond Activation Using Valence-to-Core X-ray Emission Spectroscopy, J Am Chem Soc 135, 11803-11808.
[13] Rees, J. A., Martin-Diaconescu, V., Kovacs, J. A., and DeBeer, S. (2015) X-ray Absorption and Emission Study of Dioxygen Activation by a Small-Molecule Manganese Complex, Inorg Chem 54, 6410-6422.
[14] Rees, J. A., Bjornsson, R., Kowalska, J. K., Lima, F. A., Schlesier, J., Sippel, D., Weyhermueller, T., Einsle, O., Kovacs, J. A., and DeBeer, S. (2017) Comparative electronic structures of nitrogenase FeMoco and FeVco, Dalton T 46, 2445-2455.
[15] Van Kuiken, B. E., Hahn, A. W., Maganas, D., and DeBeer, S. (2016) Measuring Spin-Allowed and Spin-Forbidden d-d Excitations in Vanadium Complexes with 2p3d Resonant Inelastic X-ray Scattering, Inorg Chem 55, 11497-11501.