Ein Gemeinschaftsprojekt unter der Leitung von Wissenschaftler*innen der DeBeer-Abteilung hat den katalytischen Mechanismus der Molybdän-Nitrogenase, eines für den biologischen Stickstoffkreislauf entscheidenden Enzyms, aufgeklärt. Nitrogenase spielt eine Schlüsselrolle bei der Umwandlung von atmosphärischem Stickstoff (N₂) in Ammoniak (NH₃) unter Umgebungsbedingungen - ein Prozess von immenser agronomischer und ökologischer Bedeutung. Im Gegensatz zum energieintensiven Haber-Bosch-Verfahren erreicht die Nitrogenase diese Leistung mit minimalem Energieaufwand. Trotz bedeutender Fortschritte beim Verständnis des katalytischen Mechanismus des Enzyms gibt es noch viele offene Fragen, insbesondere zur Dynamik des Elektronen- und Protonentransfers.
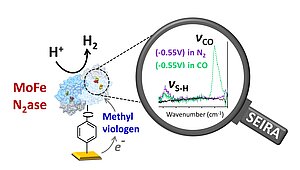
In dieser Studie wurde das auf Molybdän basierende Nitrogenaseprotein (MoFe) kovalent an Goldelektroden gebunden, was es den Forscher*innen ermöglichte, einen milden Vermittler zu verwenden, um den natürlichen Elektronenfluss zu seinem aktiven Zentrum, FeMoco, nachzuahmen. Mit Hilfe fortschrittlicher spektroelektrochemischer Techniken beobachtete das Team zum ersten Mal experimentell sowohl terminale als auch verbrückende S-H-Streckungsfrequenzen. Diese Beobachtungen liefern einen direkten Beweis für die Protonierung der verbrückenden Sulfide von FeMoco während des enzymatischen Umsatzes - ein wesentlicher Schritt im katalytischen Zyklus.
Zu den wichtigsten Ergebnissen gehören auch Erkenntnisse über die CO-Hemmung, wobei das Team die Dynamik der CO-Bindung und -Entbindung am aktiven Zentrum des Enzyms unter elektrochemischen Bedingungen charakterisierte.
Die Arbeit hebt die Synergie zwischen experimentellen und theoretischen Ansätzen hervor, wobei oberflächenverstärkte Infrarot-Absorptionsspektroskopie (SEIRA) in Verbindung mit quantenmechanischen/molekularmechanischen (QM/MM) Berechnungen eingesetzt wird. Es wird erwartet, dass die Ergebnisse künftige Studien über alternative Nitrogenasen, wie z. B. Systeme auf Vanadium- und Eisenbasis, und deren Anwendung in der nachhaltigen Stickstofffixierung und der Biohybridkatalyse inspirieren werden.
Das open access paper wurde kürzlich im Journal of the American Chemical Society veröffentlicht.
Hauptautoren: Kushal Sengupta, Olaf Rüdiger, Serena DeBeer
Original Publikation: Kushal Sengupta, Justin P. Joyce, Laure Decamps, Liqun Kang, Ragnar Bjornsson, Olaf Rüdiger, and Serena DeBeer. Investigating the Molybdenum Nitrogenase Mechanistic Cycle Using Spectroelectrochemistry (2025) Journal of the American Chemical Society Article ASAP DOI: 10.1021/jacs.4c16047 Link